
FDA 第三方审核
代孕 代孕中介 代孕妈妈 捐卵 捐卵 借腹生子 r4 マジコン販売
对于占有60%美国市场份额的II类产品,FDA在麻醉、心血管、临床化学、牙科、耳鼻喉、肠胃、整形外科、常规设备、血液学、免疫学、微生物学、神经学、产科、眼科、病理学、物理治疗学、放射学和毒物学等15类产品范畴中,抽取了部分产品(I类和II类需要完成510(K)申报方能进入美国市场、不属于植入式、支持或维护生命设备、且不需要进行人体临床研究的产品)授权给了11家机构(表2所示)进行第三方审核,从而加快了这类产品完成美国市场准入的进度。(当然,对于可由第三方审核的医疗器械,制造商仍然可以向FDA直接申请市场准入审核,而并非必须要经由第三方机构。)
BRITISH STANDARDS INSTITUTION | TUV SUD AMERICA, INC. |
CENTER FOR MEASUREMENT STANDARDS OF INDUSTRIAL | UNDERWRITERS LABORATORIES, INC. |
CITECH | CHEIROON BV |
INTERTEK TESTING SERVICES | KEMA QUALITY B.V. |
NIOM - SCANDINAVIAN INSTITUTE OF DENTAL MATERIALS | REGULATORY TECHNOLOGY SERVICES, LLC |
TUV RHEINLAND OF NORTH AMERICA, INC. |
表2 FDA授权第三方审核机构列表
1.成为FDA授权第三方审核机构应具备的资格
美国食品药品及化妆品法案FD&C Act第704条款规定了成为FDA授权第三方审核机构应满足的基本要求:
(1)必须是合法的实体机构,但不得隶属于联邦政府。必须是不受制造商、供应商或卖主控制的独立组织,不和制造商、供应商和卖主之间有组织结构上、实际性的和财务上的利益关系,并且不从事医疗器械的设计、装配、销售或维修工作。
(2)必须有足够的拥有审核和检查经验、技巧及受过必须培训和教育的工作人员,FDA要求第三方审核机构工作人员应当熟悉美国食品药品及化妆品法案(FD&C Act)、公众健康服务法(Public Health Service Act)以及21CFR相关法规的要求。
(3)FDA将采用TPRB(Third Party Recognition Board)程序来评估申报机构是否具备第三方审核能力。
2.FDA授权第三方审核机构市场准入审核流程: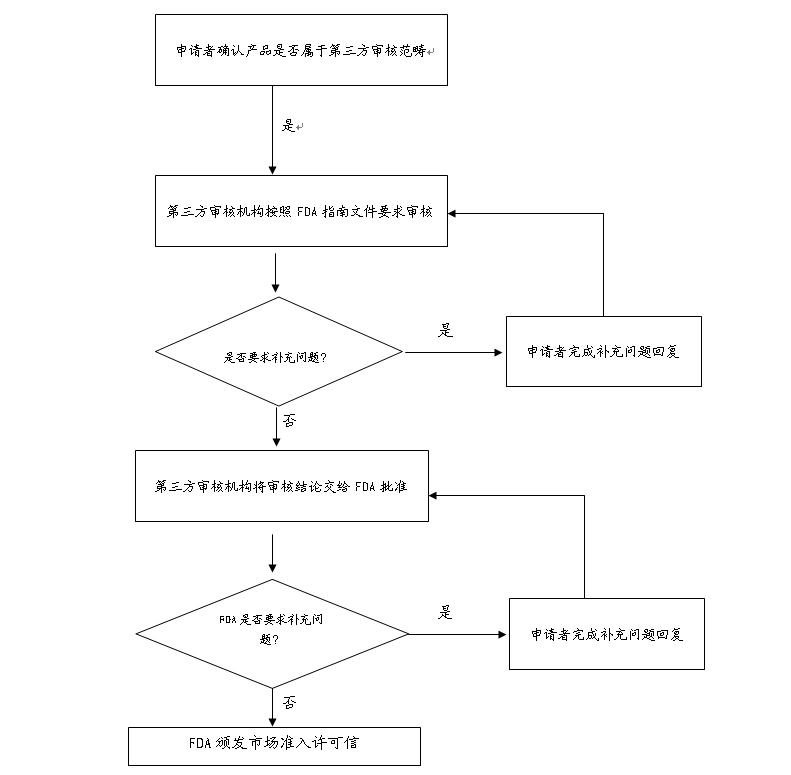
第三方机构在对制造商递交的市场准入文档进行初步审核后,将审核意见、建议以及510(K)文档转交给FDA,按照法规的要求,FDA必须在30天之内作出是否颁发市场准入许可信的决定。选择FDA授权第三方审核机构与选择直接向FDA递交市场准入审核差异表如下所示:
编号 | 项目名称 | 选择FDA授权第三方审核机构 | 直接向FDA递交 |
1 | FDA User Fee (2007年财政年) | 一般是FDA User Fee的2-3倍 | 4180美元 |
2 | 市场准入文档审核时间 | 第三方机构一般在30天之内完成文档审核,并将审核意见反馈给FDA后,若FDA无补充问题的要求,则会在30天之内(一般是15天)颁发市场准入许可信。 | 90天 |
3 | 补充问题的回复时间(若有) | 第三方会采取及时交流的方式 | 30天 |
4 | 补充问题回复后FDA颁发市场准入许可信时间 | 30天(一般是15天) | 法规规定为90天(一般是60天) |
3.FDA对第三方审核机构的监管
隶属于FDA器械和放射卫生中心(CDRH)的投诉监督办公室(OC)将对FDA授权的第三方审核机构依法进行监管。
FDA将会对由第三方审核机构完成的审核项目进行复审,并定期对第三方审核机构进行检查,以确保它们按照法规的要求进行相关审核工作并记录过程。当有足够的证据表明,第三方审核机构与申报者之间存在着利益关系,FDA将会按照FD&C Act 704条款的要求启动撤销第三方审核机构资格的程序。
FD&C Act 704条款规定,当第三方审核机构未按照标准和法规的要求履行程序,对公众健康带来威胁,或与设备制造商等机构之间存在利益关系时,FDA将会撤销第三方审核机构资格。而截止到目前为止,FDA尚未对已经授权的第三方审核机构做出撤销资格的判定。
GHTF格慧泰福技术服务机构提供的服务包括:
1) 协助企业建立QSR 820质量管理体系
2) 模拟美国FDA工厂审核,并纠正企业现有质量系统的不足
3) 亲自陪同美国FDA工厂审核全过程,协助企业顺利通过美国FDA审核
4) 和美国FDA官员保持良好沟通
5) 由我司专家提供现场翻译
我们具有丰富的QSR820质量体系管理经验,成功协助国内50余家医疗器械企业通过了FDA工厂审核。
-
服务流程资料添加中....
- 官方收费资料添加中....
- 基础法规资料添加中....
- 相关服务资料添加中....



















 全国服务热线:
全国服务热线:
